国产与进口奥氮平片的人体药代动力学及生物等效性
李文标 王传跃 翟屹民 翁永振 姜佐宁
(首都医科大学附属北京安定医院临床精神药理实验室,北京 100088 )
[摘要] 目的:考察健康受试者口服奥氮平片的药代动力学,比较国产制剂与进口制剂的生物等效性。 方法: 采用双周期两制剂交叉试验设计,将 22 名男性健康志愿者随机分为两组,交叉单次剂量口服国产或进口奥氮平片 10mg ,用高效液相色谱电化学检测法测定给药后不同时间点血浆中奥氮平的浓度,采用 3P97 非房室模型法生物等效性计算程序进行统计分析。
结果: 单次口服国产和进口奥氮平片后的血药浓度时间曲线相似,主要药代动力学参数Cmax 分别为(20.77±4.86)和(19.31±4.80) μg×L-1 ; T max 分别为(2.91±0.68)和(3.73±1.24) h ; AUC 0 ~ 144 分别为(643.94±156.35)和(636.53±187.19) μg×h×L-1 ; AUC 0 ~ ∞ 分别为(688.42±156.19)和(684.85±192.66) μg × h × L-1 。国产奥氮平片对进口奥氮平片的相对生物利用度 F-AUC 0 ~ 144 为(105.2±25.0) % , F-AUC 0 ~ ∞ 为( 104.8±27.9 ) % 。除 T max 外(P<0.05 ,主要药代动力学参数 C max 、 AUC 0 ~ 144 和 AUC 0 ~ ∞ 均无显著性差异(P>0.05)。
结论: 国产和进口奥氮平片具有生物等效性。
[关键词] 奥氮平 药代动力学 生物等效性 片剂 高效液相色谱 电化学检测法
Human pharmacokinetics and bioequivalence of domestic and imported
olanzapine tablets
LI Wen-biao, WANG Chuan-yue, ZHAI Yi-min, WENG Yong-zhen and JIANG Zuo-ning
(Laboratory of Clinical Psychopharmacology, Beijing Anding Hospital, Affiliate of the Capital University of Medical Sciences, Beijing 100088, China)
【 Abstract 】 Objective : To study the pharmacokinetics of olanzapine tablets after oral administration, compare the bioequivalence of domestic and imported olanzapine tablets. Methods: 22 male volunteers received an oral single-dose of 10mg domestic and imported olanzapine tablets respectively by a randomized 2way crossover design. The plasma olanzapine concentrations of deferent time were determined by high-performance liquid chromatography with electrochemical detection. The pharmacokinetic parameters of olanzapine and the bioequivalence of the two formulations were evaluated by 3P97 program. Results: The plasma drug concentration—time curves of the two formulations were very similar. The main pharmacokinetic parameters of both domestic and imported were given respectively as following: C max were (20.77±4.86) and (19.31±4.80)μg × L-1 , T max were (2.91±0.68) and (3.73±1.24)h , AUC 0 ~ 144 were (643.94±156.35) and (636.53±187.19) μg×h×L-1 , AUC 0⺷∞ were (688.42±156.19) and (684.85±192.66) μg×h×L-1 。 The relative bioavailability of domestic to imported tablets were: F-AUC 0 ~ 144 = ( 105.2±25.0 ) % , F-AUC 0 ~ ∞ = ( 104.8±27.9 ) % 。 No significant deference was found for the pharmacokinetic parameters C max , AUC 0 ~ 144 and AUC 0 ~ ∞ (P > 0.05), except T max (P < 0.05). Conclusion: Domestic and imported olanzapine tablets are of bioequivalence.
[ key words ] olanzapine; pharmacokinetic; bioequivalence; HPLC; electrochemical detection
奥氮平 (Olanzapine) 为新型非典型抗精神病药物,化学结构与氯氮平相似,药理作用近似,对于精神分裂症病人的阳性症状和阴性症状均有良好疗效,而极少引起锥体外系反应,对血清催乳素水平影响小,不引起粒细胞缺乏症 [1~2] 。奥氮平与多巴胺 D 1 、 D 2 和 D 4 受体, 5- 羟色胺 5-HT 2a 、 5-HT 2c 和 5-HT 3 受体, a 1 受体, H 1 受体, M 受体均具有一定的亲和力,其中与 D 2 受体的亲和力较弱但比氯氮平强,与 N- 胆碱受体无结合。同服用奥氮平有关的主要不良反应是嗜睡和体重增加,偶见用药初期出现肝脏转氨酶 SGPT 和 SGOT 一过性轻度升高。目前在我国上市的主要是美国礼来公司生产的奥氮平片剂,由于价格昂贵,许多病人难以承受。国产奥氮平片已由国家食品和药品监督管理局批准上市。本试验对奥氮平在中国人男性健康志愿者体内的药代动力学进行了研究,并且比较了国产奥氮平片剂与美国礼来公司生产的奥氮平片剂的生物等效性。
材料与方法
1. 药品与试剂
受试制剂为常州华生制药有限公司生产的奥氮平片剂,规格 5 mg/ 片,批号 20000709 ,药检合格。参比制剂为美国礼来公司生产的奥氮平片剂,商品名再普乐( Zyprexa ),规格 5 mg/ 片,批号 C5358C 。奥氮平和内标乙基奥氮平标准品由常州华生制药有限公司提供,纯度均 ≥99.9% 。维生素 C 购自美国 Sigma 公司,甲醇和乙腈为市售色谱纯试剂,乙醚、磷酸二氢钾、磷酸氢二钠、无水碳酸钠、盐酸、二氯二甲基硅烷等试剂均为市售分析纯。市售分析纯乙醚需经重蒸后一月内使用。氮气为高纯氮。空白血浆为健康人之混合血浆。
2. 仪器
日立 L-6200 型高效液相色谱泵,美国 BIO-RAD1640 型电化学检测器,日立 D-2500 型色谱积分仪。样本预处理所用试管及其它玻璃器皿均需经二氯二甲基硅烷硅化后使用。
3. 受试对象
22 例健康男性受试者平均年龄( 24.91±5.67 )岁,平均体重( 65.32±9.91 ) Kg ,平均身高( 170.95±5.78 ) cm 。受试者既往均无重大疾病史,体格检查血压、呼吸、脉搏、血尿常规、肝肾功能、心电图等方面均无异常发现。受试前两周及受试期间未用其它药物。受试期间禁用烟、酒及含咖啡因的饮料。所有受试者均自愿接受本试验,签署知情同意书。
4. 给药方法
采用双周期两制剂交叉试验设计。将 22 名符合入组条件的健康志愿者按随机数字表法分为 A 和 B 两组,每组 11 名。两组受试者分别单次口服受试或参比奥氮平片 10mg ,定时采血。采血结束后间隔 3 周,然后交叉给药,重复试验。受试者于服药前 1 天傍晚入住病房,禁食 12 小时,服药当日清晨空腹单次剂量口服国产或进口奥氮平片 10mg ,用温开水 250ml 吞服, 2 小时后给予低脂肪饮食。受试者服药前一天的晚饭及服药后 2 天内接受统一的低脂肪标准餐,以后改为普通饮食。
5. 血样采集
所有受试者分别在服药前和服药后的 1 、 2 、 3 、 4 、 6 、 8 、 12 、 24 、 36 、 48 、 72 、 96 、 120 、 144 小时,取前臂静脉血 5ml ,置于统一的肝素化试管中,立即混匀, 4000rpm 离心 5min 分离血浆,取双份各 1ml 血浆,置于含有 0.1mol × L -1 的维生素 C 溶液 0.5ml 的 Eppendorf 管中,混匀, -20 ° C 冻存,统一测定。
6. 临床观察
整个试验过程在首都医科大学附属北京安定医院,由医护人员密切监护下进行。受试者服用奥氮平后,定时观察与记录血压、呼吸、脉搏、体温和不良反应,填写不良反应登记表。服药后住院观察 2 天,以后可自由活动,严格定时采血。最后一次采血时,复查血生化(包括肝肾功能)。
7. 血药浓度测定方法
采用高效液相色谱电化学检测法测定血浆样本中奥氮平的浓度。所有受试者两次服药后采集的样本均在同一批内测定。每批测定在同一天完成,采用当日标准曲线,同时测定预先统一配制的奥氮平浓度为 1 、 8 、 32 m g·L -1 的质控血浆各一份。
7.1 色谱条件 色谱柱为 Inertsil ODS-3 , 5 m m , 4.6mm×150mm (日本 GL Science );流动相为甲醇 : 乙腈 : 超纯水 :50mmol × L -1 KH 2 PO 4 溶液 :50mmol × L -1 Na 2 HPO 4 溶液以 32:26:8:20:14 的比例混合,经 0.45 m M 微孔滤膜负压过滤而成;流速为 2.0ml × min -1 ;电化学检测器的检测电压为 0.32V ,灵敏度 10nA × V -1 ,基线 0.15V ;积分仪纸速 0.25cm × min -1 。
7.2 血浆样品预处理 待测血浆 1ml 加入含有 0.1mol × L -1 维生素 C 溶液 0.5ml 的试管中,加入浓度为 160 m g·L -1 的内标 LY170222 甲醇溶液 50 m l ,混匀,再加入 1mol × L -1 的 Na 2 CO 3 溶液 0.5ml ,重蒸乙醚 4ml ,旋涡混合 2min , 4000 r·min -1 离心 5min 。取出上层乙醚, 40 ° C 水浴下氮气吹干,再用流动相 50 m l 溶解, 4000r·min -1 离心 5min ,取 25 m l 进样。
7.3 标准曲线制备 1ml 空白血浆 8 份,依次分别加入甲醇和浓度为 10 、 20 、 40 、 80 、 160 、 320 和 640 m g·L -1 的奥氮平标准甲醇溶液 50 m l ,得奥氮平浓度分别为 0 、 0.5 、 1 、 2 、 4 、 8 、 16 和 32 m g·L -1 的系列血浆液。各加入 0.1mol × L -1 的维生素 C 溶液 0.5ml ,混匀,按 7.2 项所述方法进行处理。以奥氮平与内标的峰高比与奥氮平浓度进行线性回归,求算标准曲线。
8. 数据分析
采用中国药理学会数学专业委员会编制的 3P97 非房室模型法生物等效性计算程序进行统计分析。以梯形法计算两种制剂各自的 AUC 0 ~ 144 、 AUC 0 ~ ∞ , C max 和 T max 采用实测值。以方差分析、双单侧 t 检验和 90% 可信区间,考察两种制剂的生物等效性。
结 果
1. 血药浓度测定方法的评价
1.1 色谱图及特异性 奥氮平和内标的保留时间分别为 4.54min 和 7.26min ,两者峰型良好,分离完全,内源性物质和奥氮平代谢产物均不干扰样本测定,见图 1 。
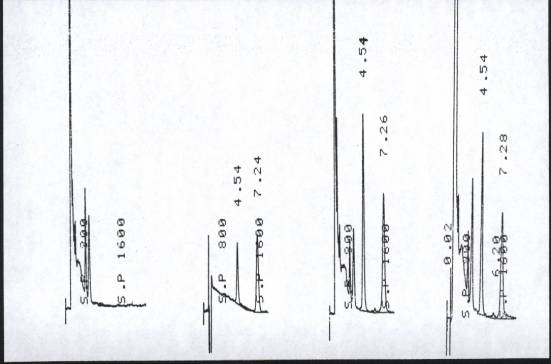 图 1. 色谱图 奥氮平保留时间 4.54min 内标保留时间 7.26min 图 1. 色谱图 奥氮平保留时间 4.54min 内标保留时间 7.26min
A :空白血浆 B :含奥氮平 40 m g·L -1 与内标 80 m g·L -1 的标准甲醇溶液直接进样
C :含奥氮平 8 m g·L -1 及内标的标准血浆 D :志愿者服药后血浆
Fig 1. Chromatogram The retention time of olanzapine and internal standard is 4.54min and 7.26min
A : blank plasma; B : director injection of 40 m g·L -1 olanzapine and 80 m g·L -1 internal standard in methnol; C : plasma of 8 m g·L -1 olanzapine and internal standard; D : plasma of a volunteer after oral dose.
1.2 标准曲线与线性关系 在 0.5 ~ 32 m g·L -1 的范围内,奥氮平峰高与内标峰高之比和奥氮平血浆浓度之间具有良好的直线相关关系。标准曲线的线性方程为: y=-0.00296+0.19720x , r=0.9993 。其中 y 为奥氮平与内标的峰高比; x 为血浆奥氮平浓度。
1.3 回收率和精密度 用空白血浆配制奥氮平标定浓度为1、8和32 m g · L -1 ,内标浓度为8 m g · L -1 的血浆,按上述7.方法测定。以含药血浆经提取后测得的色谱峰高与相应浓度药物甲醇溶液直接进样的色谱峰高的百分比为绝对回收率;以奥氮平测得浓度与标定浓度的百分比为相对回收率,结果见表1。6份含8 m g · L -1 内标血清测定的内标提取回收率为85.05 ± 2.08%,RSD为2.47%。
表 1 .高效液相色谱电化学检测法测定奥氮平血浆浓度的回收率和精密度
Table 1. Recovery and accuracy for the determination of plasma olanzapine concentration by high-performance liquid chromatography with electrochemical detection
|
浓度 / m g·L -1
|
相对回收率 /%
(n=6)
|
绝对回收率 /%
(n=6)
|
日内 RSD/%
(n=6)
|
日间 RSD/%
(n=22)
|
|
1
|
108.17±3.06
|
85.28±4.78
|
2.78
|
10.21
|
|
8
|
105.21±6.69
|
80.42±4.59
|
6.29
|
9.22
|
|
32
|
104.39±8.58
|
81.25±5.59
|
8.34
|
8.91
|
2. 血药浓度 — 时间曲线
22 名健康志愿者单剂量口服国产和进口奥氮平片 10mg 后的平均血药浓度 — 时间曲线见图 2 。
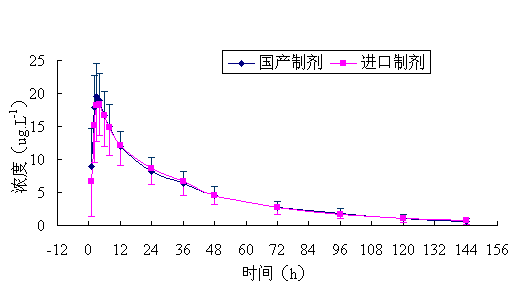
图 2. 22 名男性健康志愿者单剂量口服国产和进口奥氮平片 10mg 后的平均血药浓度 — 时间曲线
Fig 2. Mean plasma concentration-time curves of domestic and imported olanzapine tablets after a single oral dose in 22 healthy male volunteers.
3. 主要药代动力学参数
采用 3P97统计软件求算的22例健康受试者单剂量口服奥氮平10mg的主要药代动力学参数见表2。
表 2 .单剂量口服国产和进口奥氮平片剂后的主要药代动力学参数
Table 2. Main pharmacokinetic parameters of domestic and imported olanzapine tablets after a single oral dose.
|
参 数
|
国产片剂
|
进口片剂
|
|
AUC 0 ~ 144 /μg × h × L -1
|
643.94±156.35
|
636.53±187.19
|
|
AUC 0 ~ μ /μg × h × L -1
|
688.42±156.19
|
684.85±192.66
|
|
C max / m g·L -1
|
20.77±4.86
|
19.31±4.80
|
|
T max /h
|
2.91±0.68
|
3.73±1.24
|
|
T 1/2ke /h
|
36.78±8.80
|
33.67±7.20
|
|
MRT 0~t /h
|
36.32±4.41
|
34.90±5.96
|
|
MRT 0~ μ /h
|
46.77±8.66
|
45.80±9.54
|
4. 生物等效性判定
受试奥氮平片相对生物利用度 F-AUC 0 ~ 144 为( 105.2±25.0 ) % , F-AUC 0 ~ ∞ 为( 104.8±27.9 ) % 。对两种片剂的 AUC 0 ~ 144 、 AUC 0 ~ ∞ 和 C max 进行方差分析、双单侧检验及 90% 可信限考察,表明两种制剂具有生物等效性(见表 3 ),但秩和检验的结果表明受试奥氮平片剂的实测 T max 短于参比片剂( Z=-2.428 , P < 0.05 )
表 3 .国产和进口奥氮平片剂的生物等效性分析
Table 3. Bioequivalent analysis of domestic and imported olanzapine tablets
|
参 数
|
T 1
|
T 2
|
P 值
|
90% 可信限
|
|
ln AUC 0~144
|
5.539
|
4.282
|
0.5364
|
95.1~111.3
|
|
ln AUC 0~∞
|
5.141
|
4.251
|
0.6614
|
94.1~110.9
|
|
lnC max
|
6.959
|
3.351
|
0.0863
|
100.3~116.5
|
5. 不良反应监测
22 例受试者服用受试和参比奥氮平片后,均出现不同程度的嗜睡,发生率为 100% 。其它不良反应有头晕、心动过缓、心动过速、体位性低血压、口干、无力和恶心。这些不良反应均不严重,无需处理,可自然缓解(见表 4 )。
表 4 . 22 例志愿者单剂量口服国产与进口奥氮平片后的不良反应
Table 4. Adverse reactions of domestic and imported olanzapine tablets after a single oral dose in 22 volunteers
|
不良反应
名 称
|
受试片发生例数
( 发生率 )
|
参比片发生例数
( 发生率 )
|
说 明
|
|
嗜睡
|
22 (100%)
|
22 (100%)
|
多在服药后 1-4 小时出现,为轻度到中度,多在 8~12 小时减轻或消失。
|
|
头晕
|
7 (31.82%)
|
7 (31.82%)
|
出现在服药后 4~12 小时,轻到中度
|
|
心动过缓
|
3 (13.64%)
|
6 (27.28)
|
心率 46~60 次 /min ,见于服药后 4~8 小时,持续 1~2 小时
|
|
心动过速
|
2 (9.09%)
|
3 (13.64%)
|
出现在服药后 8~36 小时,心率 100~110 次 / 分,持续 1~2 小时
|
|
体位性低
血压
|
2 (9.09%)
|
1 (4.55%)
|
血压降至 95/50mmHg ,见于服药后 4~8 小时
|
|
无力
|
1 (4.55%)
|
2 (9.09%)
|
出现在服药后 1~12 小时,轻度到中度
|
|
口干
|
1 (4.55%)
|
1 (4.55%)
|
出现在服药后 1~12 小时,轻度到中度
|
|
恶心
|
1 (4.55%)
|
0
|
短时,轻度
|
讨 论
已报道的奥氮平血药浓度测定方法包括高效液相色谱质谱检测法 [3-5] 、紫外检测法 [6-8] 和电化学检测法 [9-10] 等。由于奥氮平的日剂量仅为 5 ~ 20mg [ 1-2 ] ,治疗精神分裂症的有效血清域浓度约为 9 m g·L -1 [ 9 ] ,紫外检测法的灵敏度可以满足治疗药物监测的需要,但难以满足药代动力学研究的要求,而质谱检测法所需仪器昂贵,我们参考 Aravagiri 等 [ 9 ] 和 Catlow 等 [ 10 ] 的方法在我国首先建立了测定奥氮平浓度的高效液相色谱电化学检测法 [ 11 ] ,具有灵敏度高、特异性强、操作简单等优点。最初建立的方法一次进样分析需要 15 分钟,较为耗时。由于本试验的样本测定量较大,我们改用了与原来相同型号的短色谱柱,并对流动相进行了调整,使一次进样的分析时间缩短为 9 分钟,因而明显提高了分析检测的效率。本研究所用测定法符合 2000 年版《中国药典》 [ 12 ] 的要求,样本测定在严格的质量控制下进行。
奥氮平在中国人体内的药代动力学研究尚未见报道。据国外 Nyhart 等 [ 13 ] 报道,口服奥氮平片剂 15mg 的平均 C max 、 T max 、 AUC 0~ μ 和 T 1/2ke 分别为 13.45 m g·L -1 、 5.9h 、 498±136μg × h × L -1 和 29.1±5.8h 。据国外文献 [ 3 ] 所述,奥氮平口服后 5~8h 达到血浆峰值浓度,平均消除半衰期为 33h(5% 至 95% 为 21 至 54 小时 ) 。本试验结果表明, 22 例志愿者口服 10mg 受试和参比奥氮平片后,其 C max 分别为 20.77±4.86 和 19.31±4.80 m g·L -1 , T max 分别为 2.91±0.68 和 3.73±1.24h , t 1/2ke 分别为 36.78±8.80 和 33.67±7.20h , AUC 0 ~ 144 分别为 643.94±156.35 和 636.53±187.19μg × h × L -1 , AUC 0 ~ ∞ 分别为 688.42±156.19 和 684.85±192.66μg × h × L -1 。可见 C max 、 T max 和 AUC 0~∞ 与文献报道的值有较大差别,但是 T 1/2ke 无明显差别。提示中国人口服奥氮平后吸收较快,峰浓度较高,有可能使用较低的日剂量。这种差异可能与受试者体重较轻及代谢方面的差异有关,有待进一步研究。
国产奥氮平片对进口奥氮平片的相对生物利用度 F-AUC 0 ~ 144 为( 105.2±25.0 ) % , F-AUC 0 ~ ∞ 为( 104.8±27.97 ) % 。采用 3P97 生物等效性检验程序,对两种奥氮平片剂采用梯形法计算的 AUC 0 ~ 144 、 AUC 0 ~ ∞ ,实测 C max 、 T max 和 T 1/2ke 进行多因素方差分析和双单侧 t 检验,结果表明两种片剂的 AUC 0 ~ 144 、 AUC 0 ~ ∞ 、 C max 和 T 1/2ke 均无显著性差异( P > 0.05 ), t 1 和 t 2 值均大于 1.725 。两种片剂 AUC 0 ~ 144 和 AUC 0 ~ ∞ 经对数转换后,比值的 90% 的可信区间分别为 95.1% ~ 111.3% 和 94.1%~110.9% ; C max 经对数转换后,两种制剂比值的 90% 的可信区间为 100.3% ~ 116.5% 。以上结果符合我国药典判定生物等效性的要求 [12] ,故可认为国产奥氮平片与进口奥氮平片在人体具有生物等效性。方差分析和双单侧 t 检验的结果表明,受试奥氮平片的 T max 短于参比奥氮平片 (P < 0.05, t 1 < 1.725 ) , 提示常州华生制药公司生产的奥氮平片崩解和吸收较快,但并不具有临床意义。
本次试验观察到的不良反应主要是嗜睡,几乎所有受试者服用受试和参比奥氮平片后均感到不同程度的困倦,这与奥氮平的镇静作用及服药后卧床休息有关,另外健康人比精神分裂症病人对奥氮平可能更为敏感。其它不良反应有头晕、心动过缓、心动过速、体位性低血压、口干、无力和恶心。这些不良反应均不严重,无需处理,可自然缓解。在呼吸、体温、心电图、 B 超、血生化、血尿常规等方面均无异常发现。
[ 作者简介 ] 李文标( 1963- ),男,医学硕士,副主任技师,主要从事临床精神药理学研究工作。联系电话:( 010 ) 82085468 , 82085467 , E-mail: swbli@sina.com 。
参考文献
[1] 舒良 , 刘平 . 新型非典型抗精神病药奥氮平 . 中华精神科杂志 , 1999, 32 (4): 123.
[2] 陆国才 , 袁伯俊 . 新一代抗精神分裂症药物奥氮平 . 中国新药杂志 , 1999, 8(3) : 161.
[3]Berna M, Shugert R, Mullun J. Determination of olanzapine in human plasma and serum by liquid chromatography/tandem mass spectrometry. J. Mass Spectrom., 1998, 33: 1003-1008.
[4]Bogusz MJ, Kruger KD, Maier RD, et al. Monitoring of olanzapine in serum by liquid chromatography-atmospheric pressure chemical ionization mass spectrometry. J Chromatogr B, 1999, 732: 257-269.
[5]Berna M, Ackermann B, Ruterbories K, Glass S. Determination of olanzapine in human blood by liquid chromatography-tandem mass spectrometry. J Chromatogr B Analyt Biomed life Sci. 2002, 767(1): 163-168.
[6]Dusci LJ, Peter HL, Fellows LM, Ilett KF. Determination of olanzapine in plasma by high-performance liquid chromatography using ultraviolet absorbance detection. J Chromatogr B Analyt Biomed life Sci. 2002, 773(2): 191-197.
[7]Boulton DW, Markowitz JS, DeVane CL. A high-performance liquid chromatography assay with ultraviolet detection for olanzapine in human plasma and urine. J. Chromatogr. B., 2001, 759: 319-323.
[8] 肖红 , 谢世平 , 范剑雄 , 姚辉 , 韩钢 . 高效液相色谱法测定人血浆中奥氮平的浓度 . 色谱 , 2001, 19(3): 281-283.
[9] Aravagiri M, Ames D, Wirshing WC, et al. Plasma level monitoring of olanzapine in patients with schizophrenia: determination by high-performance liquid chromatography with electrochemical detection. Ther Drug Monit, 1997, 19: 307-313.
[10] Catlow JT, Barton RD, Clemens M, et al. Analysis of olanzapine in human plasma utilizing reversed-phase high-performance liquid chromatography with electrochemical detection. J Chromatogr B, 1995, 668: 85-90.
[11] 李文标 , 翟屹民 , 王传跃 , 翁永振 . 高效液相色谱电化学检测法测定血清奥氮平浓度 . 药物分析杂志 , 2000, 20(5): 304-307 。
[12] 国家药典委员会 . 药物制剂人体生物利用度和生物等效性试验指导原则 . 中华人民共和国药典 [S]. 2000 年版 . 二部 . 北京 : 化学工业出版社 , 2000, 附录 193-196 。
[13] Nyhart EH, Cenmele Jr. BJ, Kassanun K, et al. Olanzapine: an initial assessment of the bioequivalence of capsule and tablet formulations. Pharm Res. 1995, 12(9 suppl): S-415.
[14] Callaghan JT, Bergstrom RF, Ptak LR and Beasley CM. Olanzapine: pharmacokinetic and pharmacodynamic profile. Drug Disposition, 1999, 37(3):177-193. |